Applicazioni delle membrane biomimetiche nello studio delle proteine transmembrana.
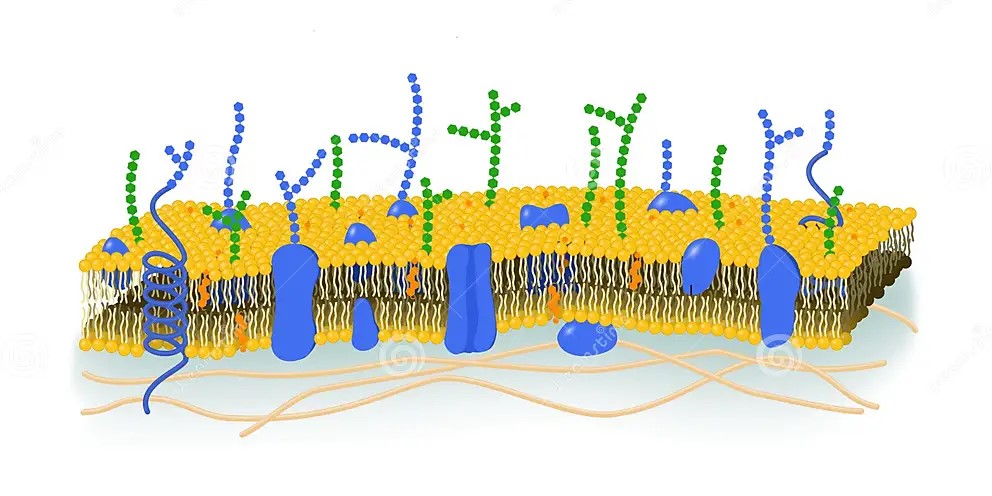
Le proteine di membrana rappresentano un altro componente delle membrane cellulari, strutturalmente diverse e con molteplici funzioni in base al tipo cellulare. Principalmente sono classificate in:
-Intrinseche (proteine transmembrana o integrali), che sono incorporate nel doppio strato lipidico e si estendono da un lato all’altro della membrana;
-Estrinseche (periferiche), che si trovano all’esterno della membrana e legate debolmente alla membrana.
Svolgono numerose funzioni, come il trasporto di ioni da una parte all’ altra della membrana, il riconoscimento cellulare, l’unione intracellulare, la composizione del citoscheletro e della matrice extracellulare e la trasduzione del segnale.
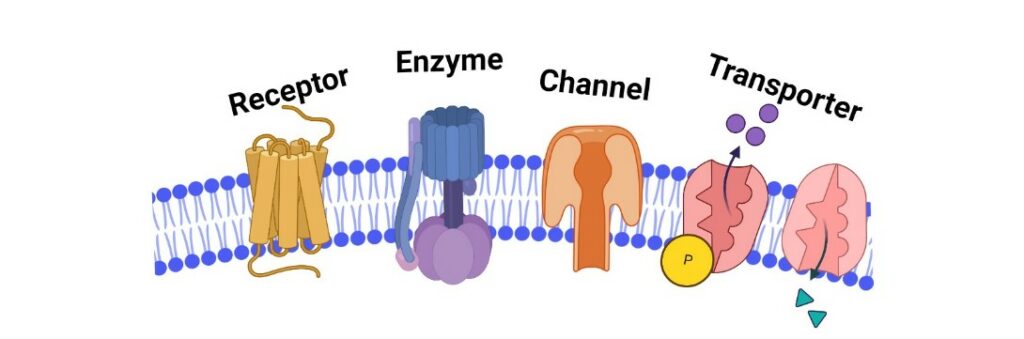
Valutare tutte queste caratteristiche è un meccanismo molto complesso è delicato. Estrarre e studiare una proteina transmembrana presenta una serie di difficoltà, in quanto la sua struttura e funzione è per lo più dettata dall’ ambiente circostante, quindi dalle interazioni con gli altri componenti della membrana, e da una serie di situazioni che si verificano a livello intra/extra-cellulare.
Per poter studiare queste proteine di membrana, gli scienziati hanno avuto la necessità di sviluppare dei sistemi modello più semplici, definiti “biomimetici” al fine di poter mimare in vitro ciò che avviene normalmente nelle membrane cellulari.
I primi studi sull’inclusione di proteine di trasporto all’interno dei doppi strati sono stati condotti sulle “Black lipid membrane”, membrane lipidiche nere sospese. Questi studi richiedevano però l’utilizzo di solventi organici in cui solubilizzare le proteine con conseguente denaturazione delle stesse.
Inoltre, questo tipo di membrane presentavano un deterioramento spontaneo dopo quasi un’ora, limitandone l’uso in esperimenti più lunghi.
Per superare queste limitazioni negli anni le membrane lipidiche nere hanno subito dei cambiamenti. Grazie allo sviluppo di membrane lipidiche “supportate” (Supported lipi membranes) e “ancorate” (Thethered lipid membranes) è stato possibile incorporare e studiare diverse proteine transmembrana per molteplici scopi. [4-5]
Con questa tecnologia è quindi possibile studiare:
-Le interazioni tra le proteine di membrana e i componenti del doppio strato fosfolipidico attraverso studi elettrofisiologia;
-Un determinato processo chimico, incorporando una proteina che funge da canale per il passaggio di ioni o piccole molecole chimiche;
-Le interazioni tra una proteina che funge da recettore e il suo ligando, mediante studi di fluorescenza o spettroscopici;
-Il coinvolgimento di quella proteina in una determinata patologia, e successivamente utilizzarla, in vitro e in vivo, come target farmacologico per un tipo di terapia sempre più personalizzata.
Referenze
- Talaikis, M., Valincius, G., & Niaura, G. (2020). Potential-Induced Structural Alterations in the Tethered Bilayer Lipid Membrane-Anchoring Monolayers Revealed by Electrochemical Surface-Enhanced Raman Spectroscopy. The Journal of Physical Chemistry C, 124(35), 19033-19045.M. https://doi.org/10.1021/acs.jpcc.0c04636
- Mouhib, M., Benediktsdottir, A., Nilsson, C. S., & Chi, C. N. (2021). Influence of detergent and lipid composition on reconstituted membrane proteins for structural studies. ACS omega, 6(38), 24377-24381. https://doi.org/10.1021/acsomega.1c02542
- Ryu, H., Fuwad, A., Kim, S. M., & Jeon, T. J. (2021). Multilayered film for the controlled formation of freestanding lipid bilayers. Colloids and Surfaces B: Biointerfaces, 199, 111552.C. https://doi.org/10.1016/j.colsurfb.2020.111552
- Pérez-Mitta, G., & MacKinnon, R. (2023). Freestanding lipid bilayer tensiometer for the study of mechanosensitive ion channels. Proceedings of the National Academy of Sciences, 120(12), e2221541120. https://doi.org/10.1073/pnas.2221541120
- Vasilca, V., Sadeghpour, A., Rawson, S., Hawke, L. E., Baldwin, S. A., Wilkinson, T., … & Jeuken, L. J. C. (2018). Spherical-supported membranes as platforms for screening against membrane protein targets. Analytical biochemistry, 549, 58-65. https://doi.org/10.1016/j.ab.2018.03.006

